Возможности клинического применения хондроитин сульфата для парентерального введения у пациентов с остеоартрозом в гериатрической практике
В статье представлены результаты проведенного проспективного клинического исследования, целью которого явилось изучение влияния болезнь-модифицирующего препарата (хондроитин сульфата) на болевой синдром и функциональные показатели в комплексной терапии остеоартроза коленных суставов у пациентов старшего возраста. Показано достоверное снижение боли и скованности по визуальной аналоговой шкале, а также функциональной недостаточности суставов через 2 мес терапии Артрадолом® для внутримышечного применения. В последующие 2 мес наблюдения сохранялся достигнутый положительный эффект. Уменьшилась потребность в дополнительном приеме нестероидных противовоспалительных препаратов. Удовлетворенность проведенной терапией оказалась высокой как по мнению пациентов, так и врачей.
Остеоартроз (ОА) — одно из чаще всего встречающихся хронических неинфекционных заболеваний человека. ОА является главной причиной боли, нарушения трудоспособности, инвалидности, а также ограничения двигательной и социальной активности у людей старшего возраста. Поскольку ожидаемая продолжительность жизни неуклонно повышается, число пациентов с тяжелой формой ОА будет только нарастать.
Распространенность остеоартроза.
Манифестация основных клинических симптомов первичного ОА начинается, как правило, у людей после достижения ими 40 лет, а в более молодом возрасте дегенеративные изменения в суставах носят вторичный характер (после перенесенных травм, инфекций, операций). Среди взрослого населения распространенность ОА коленных и тазобедренных суставов составляет 24 и 11 %, соответственно [11]. У женщин ОА встречается чаще, чем у мужчин, и начинает развиваться значительно раньше. Эти гендерные различия особенно характерны для ОА кистей и коленных суставов. Фрамингемское исследование (1994) показало, что наличие типичных симптомов ОА кистей определялось у 16 % женщин и 8 % мужчин. По мере старения распространенность ОА увеличивалась, при этом основным фактором риска становилось ожирение [4].
Диагностика остеоартроза традиционно основывается на сочетании клинических и рентгенологических признаков заболевания. Классификационные критерии ОА были разработаны Американским колледжем ревматологов в 80-х гг. прошлого столетия и не подвергались каким-либо изменениям. Рентгенологическая стадия болезни определяется в соответствии со шкалой Келлгрена—Лоуренса.
Гетерогенность остеоартроза.
Безусловно, что ОА не может считаться однородным заболеванием, в литературе уже давно он обсуждается как гетерогенный синдром с разными фенотипическими чертами. Более того, лечение ОА должно рассматриваться только с позиции полиморбидности. Многие пожилые люди с клиническими признаками ОА нуждаются в тщательном и всестороннем обследовании из-за множественной сопутствующей патологии (артериальная гипертензия и ИБС, сахарный диабет, ожирение и др.), что оказывает значимое влияние на выбор терапии. Так, примерно в 60 % случаев пациенты с ОА крупных суставов указывали на наличие у них других хронических заболеваний [2, 3]. В связи с полипрагмазией, обусловленной полиморбидностью, возрастает риск развития побочных нежелательных явлений у пожилых пациентов с ОА. С другой стороны, наличие сопутствующих заболеваний может изменять / ускорять течение ОА.
Некоторые авторы предлагают выделять следующие фенотипы первичного ОА в зависимости от преобладания тех или иных патофизиологических механизмов: генетически детерминированный тип I, эстрогензависимый тип II, обусловленный старением тип III [6]. Другие авторы указывают на роль сахарного диабета и метаболических нарушений в генезе ОА [1, 15]. Последнее время широко обсуждается роль общей минеральной плотности костной ткани в прогрессировании ОА [7].
При остеоартрозе (ОА) в патологический процесс вовлекаются все околосуставные мягкие ткани, включая хрящ, а также субхондральная кость. В соответствии с формирующимся повреждением определенной структуры сустава также можно выделять разные фенотипы ОА. Поражение субхондральной кости (ее склерозирование) ассоциируется с болевым синдромом за счет развития ишемии и/или отека костного мозга, что в настоящее время хорошо визуализируется с помощью магнитно-резонансной томографии суставов [12]. Вместе с тем, методами визуализации можно выделить фенотипы с преобладанием потери суставного хряща (в виде сужения суставной щели, так называемая хондропения) или гипертрофическими изменениями (остеофиты). Если преимущественно поражается синовиальная оболочка, то в клинической картине будет доминировать синовит («воспалительный» фенотип). В случаях поражения околосуставных мягких тканей могут преобладать признаки бурсита и тендинита. На ранней стадии ОА все эти клинические фенотипы могут чередоваться и сочетаться, манифестируясь определенной симптоматикой. На более поздних этапах развития ОА основные симптомы болезни становятся более гомогенны [9].
Принципы оказания медицинской помощи пациентам с остеоартрозом.
В международных и отечественных рекомендациях выделяют следующие направления: нефармакологические методы воздействия, лекарственная терапия, хирургическое лечение. Последнее десятилетие стал делаться упор на разработку и внедрение в клиническую практику безлекарственной терапии. Однако перечень медицинских услуг, их количество, частота применения и продолжительность воздействия четко не определены. При этом каждое из трех направлений может иметь самостоятельное значение, вместе с тем, грамотное их сочетание, вероятно, способно оказать максимальный положительный эффект у пациентов с ОА. В настоящее время насчитывается не менее 20 международных и национальных рекомендаций и консенсусов, основанных на принципах доказательной медицины (ОА коленных и тазобедренных суставов).
В соответствии с приказом Министерства здравоохранения Российской Федерации от 12 ноября 2012 г. № 900н «Об утверждении Порядка оказания медицинской помощи взрослому населению по профилю “ ревматология ”», пациентам с ОА мелких и средних суставов, а также крупных суставов без синовита, не нуждающимся в эндопротезировании, первичная врачебная медико-санитарная помощь оказывается врачом - терапевтом или врачом общей практики (семейным врачом) после консультации врача - ревматолога. Таким образом, каждый пациент с ОА должен быть хотя бы однократно осмотрен специалистом. Вместе с тем, в большинстве стран Европейского сообщества, а также в США пациенты с ОА получают медицинскую помощь у врача общей практики.
Последние рекомендации Европейской анти- ревматической лиги (EULAR) по применению нефармакологических методов лечения ОА коленных и тазобедренных суставов были опубликованы в апреле 2013 г. [5]. Рекомендации были подготовлены группой экспертов, состоявшей из ревматологов (5), ортопедов - травматологов (2), психотерапевтов (3), физиотерапевтов (2), медицинских сестер (2), психолога, диетолога, врача общей практики, клинического эпидемиолога, врача - исследователя и двух пациентов с ОА. В основу рекомендаций был положен принцип индивидуализированной терапии (табл. 1).
В 2010 г. Оsteoarthritis Research Society International (OARSI) обновило рекомендации по лечению ОА коленных и тазобедренных суставов, основанные на систематическом анализе данных литературы за 2006—2009 гг. [14].
Принципы лечения были сформулированы следующим образом.
1. При лечении ОА необходима комбинация фармакологических и нефармакологических методов лечения.
2. Выбор метода лечения должен зависеть от:
- факторов риска ОА (ожирение, степень физической активности, механическая нагрузка на суставы и т. д.);
- общих факторов риска (возраст, пол, ко- морбидность);
- интенсивности боли;
- признаков воспаления;
- степени повреждения хряща.
3. Нефармакологические методы должны включать обучение пациентов с ОА, упражнения, снижение массы тела, использование ортезов.
4. Парацетамол — анальгетик первого ряда.
5. Местное применение нестероидных противовоспалительных препаратов (НПВП) эффективно и безопасно.
6. НПВП должны применяться при неэффективности парацетамола. При высоком риске гастропатий предпочтение следует отдавать ингибиторам ЦОГ-2.
7. Опиоиды в сочетании с парацетамолом или без него могут применяться при неэффективности НПВП и парацетамола.
8. Медленно действующие противоартрозные препараты (хондроитин, глюкозамин, диацереин, неомыляемые соединения авокадо/сои) могут оказывать симптоматический эффект, а также замедлять прогрессирование заболевания.
9. Глюкокортикоидные препараты внутрису- ставно вводятся при синовите, особенно при наличии выпота.
10. Эндопротезирование крупных суставов применимо при стойком характере боли и ограничении движений.
Таблица 1
EULAR рекомендации по лечению остеоартроза коленных и тазобедренных суставов нефармакологическими методами
| Рекомендации | Уровень доказательности |
|---|---|
| У пациентов с ОА тазобедренных и/или коленных суставов необходимо использование, прежде всего, биопсихосоциального подхода, включающего оценку: физического статуса (наличие боли, утомляемости, качество сна, оценка крупных суставов нижних конечностей, подвижности, силы, оценка симметричности суставов и осанки, наличие сопутствующих заболеваний, масса тела); повседневной физической активности; участия в работе, досуге, выполнение социальной роли; настроения; потребности и мотивации к лечению и самоконтролю над заболеванием | Ib |
| Лечение ОА тазобедренных и/или коленных суставов должно быть индивидуализировано согласно пожеланиям и ожиданиям пациента, локализации ОА, факторам риска (возраст, пол, коморбидность, ожирение, серьезные механические факторы), наличию воспаления, тяжести структурных изменений, уровню боли, ограничению повседневной активности, социальному участию и качеству жизни | Ib |
Для всех пациентов с ОА коленных/тазобедренных суставов необходима разработка индивидуализированного плана лечения, включающего нефармакологические методы:
|
Ib |
| В случае рекомендаций по изменению образа жизни пациенту с ОА тазобедренных/коленных суставов необходима разработка индивидуальной программы, включающей долгосрочные и краткосрочные цели, пути их достижения, регулярную оценку результатов и корректировку программы в соответствии с достигнутыми результатами | Ib |
Для эффективности информирование и обучение пациентов с ОА коленных/тазобедренных суставов должно быть:
|
1a |
Обучение физическим упражнениям (индивидуальное или групповое); использование бассейнов или тренажеров должно быть рекомендовано, основываясь на предпочтениях пациента и пригодности метода у этого пациента. Важные принципы всех физических упражнений включают:
|
1a |
| Пациенты с ОА коленных/тазобедренных суставов должны быть обучены регулярным ежедневным физическим упражнениям (индивидуализированный комплекс), включающим: растяжку для мышц обеих нижних конечностей; аэробные упражнения; дополнительный ряд силовых упражнений/упражнений на растяжку исходя из индивидуальных способностей пациента. Необходимы индивидуальные инструкции пациента о мерах самоконтроля нагрузки. | 1a |
Обучение снижению массы тела должно основываться на индивидуальной стратегии, направленной на наиболее успешное снижение массы тела и ее дальнейшее поддержание:
|
III для бедра, Ia для коленного сустава |
| Использование индивидуальной и комфортной обуви. | 1b |
Вспомогательные средства, приспособления для дома/работы необходимо использовать для уменьшения боли и увеличения возможностей пациента в выполнении тех или иных действий, манипуляций, например:
|
III |
Поскольку одной из основных задач, которую должен решать врач при лечении пациента с ОА, является эффективное воздействие на болевой синдром, OARSI ранжировало все возможные вмешательства (методы лечения) в зависимости от уровня доказательности и размера эффекта (табл. 2).
Таблица 2
Методы, облегчающие боль (OARSI, 2010)
| Метод | Эффективность (95 % доверительный интервал), уровень доказательности |
|---|---|
| Самоконтроль | 0,06 (0,02; 0,10), Ia |
| Обучение/информирование Упражнения при ОА коленного сустава | 0,06 (0,03; 0,10), Ia |
| Растяжка | 0,32 (0,23; 0,42), Ia |
| Аэробика | 0,52 (0,34; 0,70), Ia |
| Упражнения при ОА тазобедренного сустава | 0,38 (0,08; 0,68), Ia |
| Упражнения в воде при ОА коленного и тазобедренного сустава | 0,19 (0,04; 0,35), Ia |
| Снижение массы тела | 0,20 (0,00; 0,39), Ia |
| Акупунктура | 0,35 (0,15; 0,55), Ia |
| Электромагнитная терапия | 0,16 (-0,08; 0,39), Ia |
| Парацетамол | 0,14 (0,05; 0,22), Ia |
| Наружные НПВП | 0,44 (0,27; 0,62), Ia |
| Опиоиды | 0,78 (0,59; 0,98), Ia |
| Внутрисуставное введение глюкокортикоидов | 0,58 (0,34; 0,75), Ia |
| Внутрисуставное введение препаратов гиалуроновой кислоты | 0,60 (0,37; 0,83), Ia |
| Глюкозамина сульфат | 0,58 (0,30; 0,87), Ia |
| Глюкозамина гидрохлорид | -0,02 (-0,15; 0,11), Ib |
| Хондроитин сульфат | 0,75 (0,50; 1,01), Ia |
| Диацереин | 0,24 (0,08; 0,39), Ib |
| Неомыляемые соединения сои и авокадо | 0,38 (0,01; 0,76), Ia |
| Шиповник | 0,37 (0,13; 0,60), Ia |
| Лаваж/хирургическая санация | 0,21 (-0,12; 0,54), Ib |
Если число применяемых методов лечения практически не поменялось, то качество научных исследований, использованных при формировании рекомендаций, существенно улучшилось. В соответствии с данными, представленными в табл. 2, практикующий врач может осуществить выбор тех методов, которые составят индивидуальную программу лечения.
Американская коллегия ревматологов (ACR) также разработала рекомендации по применению нефармакологических и фармакологических методов лечения остеоартрита суставов кистей, тазобедренных и коленных суставов, обновив существовавшие ранее рекомендации от 2000 г. Рекомендации ACR (2012) предполагают, что ведением пациентов с ОА коленных и тазобедренных суставов будут заниматься врачи первого контакта в тех случаях, когда отсутствуют заболевания сердечно - сосудистой системы и нет признаков заболеваний ЖКТ в прошлом и настоящем, а также хронической болезни почек [8].
В качестве лекарственной терапии могут использоваться простые анальгетики (ацетаминофен, трамадол), НПВП местно и системно, а также внутрисуставные введения глюкокортикоидов. ACR и Американская ассоциация гериатров ввели ограничения на применение НПВП у людей старше 75 лет, предлагая не назначать их в виде таблетированных форм, а использовать только в виде гелей (кремов, мазей). В таких случаях предпочтение следует отдавать трамадолу, дулоксетину (антидепрессант) и внутрисуставным введениям гиалуроновой кислоты. Вместе с тем, существуют различия в лечебной тактике между пациентами с ОА коленных и тазобедренных суставов. Так, у пациентов с коксар- трозом местные средства неэффективны, а внутрисуставные введения нецелесообразны. Эксперты ACR обратили внимание на тот факт, что некоторые рекомендации встретили непонимание со стороны практикующих врачей по поводу того, что хондроитин и глюкозамин не являются препаратами для применения при ОА нижних конечностей. Эксперты ссылаются на несколько метаанализов и результаты исследования GAIT, в которых была показана гетерогенность размера эффекта.
Лекарственная терапия остеоартроза
Использование парацетамола в лечении ОА крупных суставов в пожилом возрасте является предпочтительным (согласно рекомендациям EULAR и OARSI). Рекомендуемая суточная доза может составлять не более 4 г/сут. По данным литературных обзоров, использование парацетамола в течение 12 нед приводило к уменьшению болевого синдрома по шкале WOMAC у 44 % пациентов, в то время как в группе плацебо — в 39 % случаев. Однако улучшение функции пораженного сустава на фоне терапии парацетамолом было статистически недостоверным.
В случае неэффективности парацетамола согласно рекомендациям EULAR и OARSI при лечении ОА крупных суставов должны быть использованы пероральные формы НПВП [13]. Однако у пациентов с повышенным гастроинтестинальным риском (в том числе при наличии в анамнезе язвенной болезни или кровотечения из верхних отделов ЖКТ, но не в течение последнего года) допустимо использование неселективных НПВП только в сочетании с гастропротекторами (ингибиторами протонной помпы) или селективных ингибиторов ЦОГ-2. Отмечено, что следует стремиться к применению минимально эффективной дозы НПВП в лечении ОА. Как селективные, так и неселективные НПВП должны использоваться с осторожностью при высоком кардиоваскулярном риске. В случае приема пациентом низких доз ацетилсалициловой кислоты или варфарина с кардиопротективной целью показано использование только селективных НПВП.
Использование НПВП для местного применения является безопасной альтернативой анальгетикам или пероральным НПВП, эффективность которых доказана во многих клинических исследованиях (согласно рекомендациям EULAR и OARSI). Хорошие результаты в терапии ОА пожилых продемонстрировали препараты местнораздражающего действия, в частности капсаицина, эффективность которого также была доказана клиническими исследованиями [10].
Опиоиды, согласно EULAR, в сочетании с парацетамолом или без него рекомендованы пациентам, не отвечающим на терапию НПВП (в том числе ингибиторами ЦОГ-2), или если лечение НПВП противопоказано по какой-либо причине. Согласно рекомендациям OARSI, терапия слабыми опиоидами может быть рассмотрена в случаях отсутствия эффекта на фоне другой медикаментозной терапии. Сильные опиоиды могут быть использованы только для купирования выраженного болевого синдрома.
По рекомендации EULAR, в пожилом возрасте при выраженной стадии ОА крупных суставов с сильным болевым синдромом, неэффективности терапии НПВП и парацетамолом и других немедикаментозных методов лечения, а также невозможности выполнить по какой-либо причине эндопротезирование сустава, показан прием опиодов и антидепрессантов.
Хондроитин сульфат (ХС) и глюкозамина сульфат (ГС) в лечении ОА. Все три основные профессиональные организации (EULAR, OARSI и ACR) сошлись во мнении, что модифицирующие средства замедленного действия в лечении ОА имеют длительную историю применения. Так, например, результаты лабораторных и клинических исследований свидетельствуют о наличии у ХС и ГС симптоматических свойств и, главное, о возможном структурно-модифицирующем эффекте препаратов. Вместе с тем, последняя версия рекомендаций OARSI свидетельствует о том, что глюкозамина гидрохлорид по своему воздействию на боль и функцию при ОА крупных суставов сравним с плацебо.
Согласно рекомендациям американских профессиональных организаций (OARSI, ACR), ХС и ГС относятся к нутриентам, хотя доказательная база по этим соединениям существует. Поскольку результаты многочисленных клинических исследований оказались неоднозначными, в США Национальным институтом здоровья в 2005 г. было завершено широкомасштабное исследование GAIT (Glucosamine/Chondroitin Arthritis Intervention Trial). В исследовании приняли участие 600 пациентов с достоверным диагнозом ОА коленных суставов и стойким болевым синдромом. Выводы были сделаны следующие:
- большую эффективность в снижении боли оказала комбинация ХС и ГС по сравнению с плацебо;
- пациенты со средним и тяжелым ОА коленных суставов, получавшие комбинацию ХС и ГС, в 79,2 % случаев отмечали достоверное снижение боли по сравнению с плацебо;
- достоверного снижения боли у пациентов, принимавших целекоксиб, ГС, ХС, плацебо в виде монотерапии в данном исследовании показано не было;
- у пациентов с невыраженным болевым синдромом в коленных суставах статистически достоверных отличий в снижении боли между группами, получавшими комбинацию ГС с ХС и плацебо, выявлено не было.
Вместе с тем, актуальными остаются наблюдательные клинические исследования, показывающие эффективность комплексных методов лечения ОА с применением разных лекарственных форм ХС.
Опыт применения Артрадола® у пациентов с ОА коленных суставов.
Нами на базе Городского гериатрического центра Санкт-Петербурга было проведено клиническое исследование, основной задачей которого явилась оценка эффективности, переносимости и безопасности хондроитина сульфата для внутримышечного применения (Артрадол).
Цель исследования — оценка влияния хондро- итина сульфата для внутримышечного применения (Артрадол®) в комплексной терапии на болевой синдром и функциональные показатели пациентов старшего возраста с ОА коленных суставов.
Критерии включения: мужчины и женщины старше 60 лет; установленный диагноз первичного тибиофеморального ОА согласно критериям АРА; боль при ходьбе ≥40 мм по визуальной аналоговой шкале (ВАШ); II или III стадия ОА по Келлгрену—Лоуренсу; потребность в приеме НПВП (прием в течение 30 дней за последние 2 мес); подписанное информированное согласие.
Материалы и методы
В исследование были включены 24 пациента с достоверным диагнозом ОА коленных суставов (критерии АРА), средний возраст — 73,4±9,5 года. Всем пациентам после клинического обследования и анализа рентгенограмм коленных суставов назначали терапию Артрадолом® в/м по схеме: Артрадол® 2,0 (лиофилизат для приготовления раствора) по 100 мг через день № 5, затем по 200 мг № 20 через день. Всего в течение 2 мес пациентам было выполнено 30 инъекций. Первые инъекции пациентам проводили в условиях стационара (8—12), последующие — в условиях поликлиники. Во время исследования пациенты получали разные НПВП в терапевтической дозе, которые были назначены ранее до момента включения в исследование (с возможным снижением дозы в последующем). Контрольную группу составили 23 пациента (средний возраст 72,6±9,4 года) с достоверным диагнозом ОА коленных суставов (критерии АРА), получавшие комплексную терапию по поводу основного заболевания без системного применения структурно-модифицирующих препаратов (хондропротекторов).
Длительность исследования составила 4 мес: мес — период лечения и 2 мес — период наблюдения. Больные обеих групп были сопоставимы по полу, возрасту, длительности заболевания ОА, ИМТ и выраженности болевого синдрома (табл. 3).
Таблица 3
Клиническая характеристика больных с остеоартрозом, включенных в исследование
| Показатель |
Артрадол® + НПВП, n=24 |
НПВП, n=23 |
|---|---|---|
| Возраст, лет | 73,4±9,5 | 72,6±9,4 |
| Длительность заболевания, лет | 6,5±6,0 | 6,2±5,4 |
| Длительность ОА | ||
| до 5 лет | 4 чел. | 5 чел. |
| 5-10 лет | 12 чел. | 11 чел. |
| более 10 лет | 8 чел. | 7 чел. |
| Полиостеоартроз с поражением коленных суставов | 19 чел. | 20 чел. |
| Двусторонний гонартроз | 5 чел. | 3 чел. |
| ИМТ, кг/м² | 311 | 313 |
| Индекс тощей массы, % | ||
| норма | 0 | 0 |
| умеренная саркопения | 289 | 311 |
| тяжелая саркопения | 711 | 689 |
| Стадия ОА | II | II |
| Сахарный диабет, % | 35 | 32 |
| Гипертоническая болезнь + + ИБС, % | 100 | 100 |
Пациенты, включенные в исследование, характеризовались наличием множественной сочетанной патологии: комбинация гипертонической болезни и ИБС встречалась у всех пациентов, 1/3 больных страдала сахарным диабетом 2- го типа. Особенностью данной группы пациентов явилось то, что дебют ОА был относительно поздним. Средняя длительность заболевания к моменту включения в исследование составила 6,55 года. 86,7 % пациентов имели полиостеоартроз с преимущественным поражением коленных суставов, 13,3 % страдали первичным двусторонним гонартрозом. В обеих группах примерно у 70 % больных по результатам оценки тощей массы выявлялась умеренная саркопения (снижение мышечной массы нижних конечностей).
Основные методы исследования:
- динамика индекса WOMAC (боли, скован - ность и функциональная недостаточность);
- тест «Встань и иди»; пациентам необходимо было встать со стула, пройти расстояние 3 м, развернуться, возвратиться и снова сесть; тест выступает в качестве оценки динамического равновесия, оценивается по пятибалльной шкале; тест выполняется за 10—12 с;
- потребность в НПВП;
- оценка эффективности терапии врачом и пациентом;
- мышечная масса нижних конечностей (программа «Все тело» на рентгеновском денситометре «Hologic»).
Результаты и обсуждение
В результате проведенного лечения препаратом «Артрадол®» у пациентов уже через 1 мес отмечали достоверное снижение боли по ВАШ (в среднем боль уменьшилась на 30,1 % к концу 2-го месяца терапии), которая не нарастала в течение последующих 2 мес наблюдения (рис. 1).
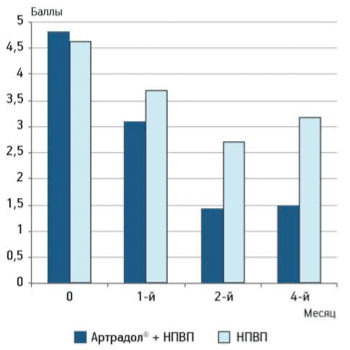
Рисунок 1.
Оценка пациентом боли по визуальной аналоговой шкале
В контрольной группе, получавшей разные НПВП для лечения ОА в терапевтических дозах, также отмечали снижение боли по ВАШ, которая вновь наросла после отмены НПВП в периоде наблюдения.
Аналогично изменению болевого синдрома на фоне лечения препаратом «Артрадол®» наблюдали отчетливое уменьшение и скованности по WOMAC (рис. 2), более выраженное, чем в группе больных, получавших только НПВП.
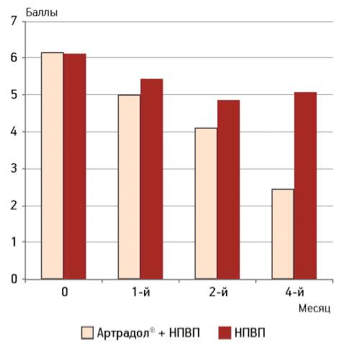
Рисунок 2.
Оценка пациентом подвижности коленных суставов
Достоверные различия между группами отмечались уже через 1 мес лечения (p=0,025) и сохранялись до конца наблюдения. Вместе с тем, в контрольной группе после перевода пациентов на режим применения НПВП по требованию скованность сохранялась на прежнем уровне.
Улучшение функционального состояния по WOMAC наблюдали в обеих группах больных, начиная с 1-го месяца лечения, однако значимые различия в группах были достигнуты к 3-му месяцу лечения: WOMAC в основной группе составил 30,14 мм против 30,5 мм в контрольной (p=0,047), рис. 3.
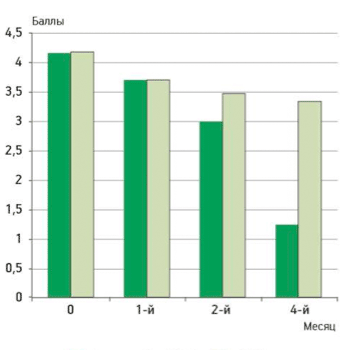
Рисунок 3.
Динамика функциональной недостаточности в суставах по визуальной аналоговой шкале
Спустя 4 мес по окончании лечения у больных контрольной группы функция суставов не ухудши - лась, в то время как у пациентов основной группы отмечалось дальнейшее улучшение функционального состояния.
Нами в исследовании применялся еще один функциональный тест, широко используемый в гериатрической практике, — «Встань и иди» (рис. 4).
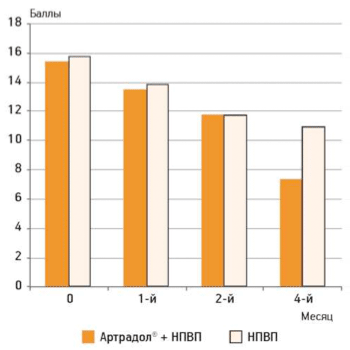
Рисунок 4.
Оценка врачом выполнения теста «Встань и иди»
На фоне терапии Артрадолом® к концу 2-го месяца у пациентов улучшилась функциональная способность, что выразилось в увеличении скорости походки при прохождении теста «встань и иди». За период дальнейшего наблюдения отмечали достоверные различия между контрольной и исследуемой группой в скорости походки.
Сравнительная эффективность лечения, оцениваемая пациентом и врачом, представлена в табл. 4.
Таблица 4
Эффективность терапии Артрадолом® оцениваемая пациентом и врачом, %
| Эффект |
Артрадол® + НПВП, n=24 |
НПВП, n=23 |
||
|---|---|---|---|---|
| Пациент | Врач | Пациент | Врач | |
| Отличный | 181 | 91 | 0 | 0 |
| Хороший | 728 | 818 | 463 | 392 |
| Умеренный | 91 | 91 | 537 | 608 |
| Отсутствует | 0 | 0 | 0 | 0 |
Анализ данных свидетельствует о том, что удовлетворенность терапией как со стороны пациентов, так и врачей оказалась высокой. Обращает на себя внимание тот факт, что в группе пациентов, получавших Артрадол®, отмечались лучшие результаты лечения. Об отсутствии клинического эффекта терапии не сообщил ни один из пациентов, включенных в исследование.
Потребность в приеме НПВП оценивали следующим образом: пациент нуждается в приеме полной (терапевтической) дозы препарата, пациент нуждается в приеме НПВП в режиме «по требованию», пациент не нуждается в приеме НПВП. Через 1 мес после начала терапии Артрадолом® все пациенты стали принимать НПВП в режиме «по требованию». В контрольной группе таких пациентов оказалось 78,1%. Только незначительная группа пациентов продолжала постоянный прием НПВП.
Побочные эффекты от применения Артрадола® наблюдали у двух больных — у одной после второй инъекции в виде местного зуда кожи, у другой — в виде покраснения в месте инъекции. В обоих случаях нежелательные явления не привели к отмене препарата.
Заключение
Комбинированная терапия гонартроза с включением Артрадола®, нестероидных противовоспалительных препаратов, лечебной физкультуры, физиотерапии в течение 2 мес (30 дней стационар и 30 дней амбулаторно) привела к снижению боли, скованности и улучшению функционального состояния пациентов. В последующие 2 мес наблюдения после прекращения терапии сохранялись / продолжили улучшаться мониторируемые показатели в группе больных, получавших Артрадол®. Кроме того, длительный период последействия Артрадола® дает возможность более гибкого использования разных схем лечения остеоартроза — постоянная терапия препаратом или прерывистые курсы лечения, сравнительная эффективность которых нуждается в дополнительной оценке. Нежелательных явлений, которые привели бы к прекращению терапии Артрадолом®, не наблюдали.
Ограничениями данного исследования являются его открытый характер, наблюдение включало как стационарный, так и амбулаторный периоды, а также использование различных нестероидных противовоспалительных препаратов.
Сильными сторонами данного исследования можно считать достигнутое значительное и стойкое (в течение 4 мес) улучшение по таким проявлениям остеоартроза, как боль, скованность, функциональное состояние пациентов с гонартрозом стадии старше 60 лет. За госпитальный период лечения удалось достаточно быстро купировать основные симптомы остеоартроза. Результаты лечения получены в условиях реальной клинической практики.
- Berenbaum F. Diabetes-induced ostheoarthritis: from a new paradigm to a new phenotype // Ann. Rheum. Dis. 2011. Vol. 70. P. 1354-1356.
- Damush T., Perkins S., Mikesky A. et al. Motivational factors influencing older adults diagnosed with knee osteoarthritis to join and maintain an exercise program // J. Aging Phys. Act. Vol. 13. P. 45-60.
- DiMatteo M, Haskard K, Williams S. Health beliefs, disease severity, and patient adherence: a meta-analysis // Med. Care. 2007. Vol. 45. P. 521-528.
- Felson A. A., Anderson D. T. The effects of specific medical conditions on the functional limitations of elders in the Framingham Study // Amer. J. Publ. Hlth. 1994. Vol. 84. № 3. P. 351-358.
- Fernandes L., Hagen K. B., Bijlsma J. W. et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis // Ann. Rheum. Dis. 2013. Vol. 10. P. 1136.
- Herrero Beaumont G., Roman-Blas J.A., Castaneda S. et al. Primary osteoarthritis no longer primary: three subsets with distinct etiological, clinical, and therapeutic characteristics // Seminars Arthr. Rheum. 2009. Vol. 39. № 1. P. 71-80
- Herrero Beaumont G, Roman-Blas J.A., Largo R. et al. Bone mineral density and joint cartilage: four clinical settings of a complex relationship in osteoarthritits // Ann. Rheum. Dis. 2011. Vol. 70. P. 1523-1525.
- Hochberg M. C, Altman R, April K. et al. American College of Rheumatology 2012 recommendations for the use of non- pharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee // Arthr. Care Res. 2012. Vol. 64. P. 465-474.
- Knoop J., Van der Leeden M., Thorstensson C. A. et al. Identification of phenotypes with different clinical outcomes in knee osteoarthritis: data from the Osteoarthritis Initiative // Arthr. Care Res. 2011. Vol. 63. P. 1535-1542
- Knotkova H., Pappagallo M., Szallasi A. Capsaicin (TRPV1 agonist) therapy for pain relief: Farewell or revival? // Clin. J. Pain. 2008. Vol. 24. P. 142-154.
- Pereira D., Peleteiro B, Araujo J. et al. The effect of osteoarthritis definition on prevalence and incidence estimates: a systematic review // Osteoarthr. Cartilage. 2011. Vol. 377. P. 21152126.
- Roemer F. W, Guermazi A., Javaid M. R. et al. Change in MRI-detected sunchondral bone marrow lesions is associated with cartilage loss: the MOST Study // Ann. Rheum. Dis. 2009. Vol. 68. P. 1461-1465.
- Towheed T. E., Maxwell L, Judd M. G. et al. Acetaminophen for osteoarthritis // Cochrane Database Systematic Rev. Vol. 1: CD004257.
- Zhang W, Moskowitz R. W, Nuki G. et al. OARSI recommendations for the management of hip and knee osteoarthritis, Part I: Critical appraisal of existing treatment guidelines and systematic review of current research evidence // Osteoarthr. Cartilage. 2007. Vol. 15. P. 981-1000.
- Zhuo Q, Yang W, Chen J. et al. Metabolic syndrome meets osteoarthritis // Nat. Rev. Rheumatol. 2012. Vol. 8. № 5. P. 729-737.